Les contaminants inorganiques émergents
Discuter des contaminants inorganiques[1] et de leur place en écotoxicologie nous restreint nécessairement au tableau périodique des éléments. En effet, contrairement à la situation qui prévaut pour les contaminants organiques, nous n’avons généralement pas à faire face à de ‘nouveaux’ composés inorganiques. Les seules exceptions évidentes à cette affirmation seraient les nanomatériaux manufacturés à base de métaux dont la taille (du nanomètre au micromètre) plutôt que la composition chimique détermine leur comportement dans l’environnement. Alors, si c’est le cas, pourquoi devons-nous continuer à nous préoccuper des contaminants inorganiques?
Comme développé ci-dessous, deux observations complémentaires nous conduisent à traiter de contaminants inorganiques émergents dans cet article :
- la tendance actuelle à l’exploitation d’éléments qui étaient auparavant rarement utilisés, et
- la demande croissante pour certains éléments qui jouent un rôle clé dans la décarbonatation de notre économie.
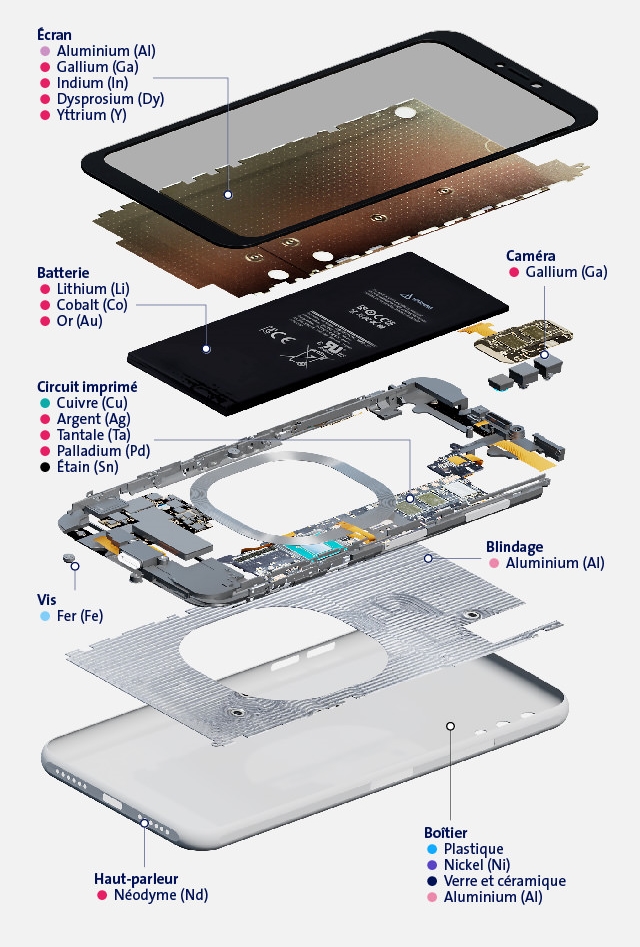
Jusqu’à la fin du XXe siècle, la plupart des utilisations industrielles des métaux non ferreux impliquaient des métaux présents dans les quatre premières rangées du tableau périodique, c’est-à-dire des éléments tels que le cuivre, le plomb, le nickel ou le zinc. Cependant, les développements récents dans des domaines tels que l’informatique, la technologie des communications, la catalyse et les technologies des énergies renouvelables ont élargi cette gamme de métaux. A titre d’exemple, la Figure 1 présente les éléments retrouvés dans un smartphone. Pour citer (et traduire) Gulley et al. (2018), « Alors que les âges antérieurs de l’histoire humaine peuvent être largement définis par un seul métal ou alliage (c’est-à-dire l’âge du fer ou l’âge du bronze), les compositions matérielles des technologies émergentes d’aujourd’hui englobent presque tout le tableau périodique et évoluent constamment ».
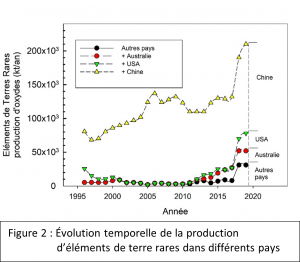
 En réponse à cette tendance, un nouveau terme a été défini avec les éléments technologiques critiques (ETC) ou simplement les éléments critiques (Cobelo-García et al., 2015). Le terme ‘critique’ fait référence ici à l’importance technologique croissante de ces éléments et, dans certains cas, au nombre limité de pays ayant des réserves connues de ces éléments. Par exemple, entre 1995 et 2005, la Chine était responsable de plus de 90 % de la production mondiale d’éléments de terres rares ou ETR (les éléments 21, 39 et 57-71 dans le tableau périodique). Ce monopole a encouragé, ailleurs dans le monde, une recherche intensive de sources alternatives pour certains de ces éléments, et les derniers chiffres de production montrent un inventaire des sources un peu plus équilibré (Figure 2).
En réponse à cette tendance, un nouveau terme a été défini avec les éléments technologiques critiques (ETC) ou simplement les éléments critiques (Cobelo-García et al., 2015). Le terme ‘critique’ fait référence ici à l’importance technologique croissante de ces éléments et, dans certains cas, au nombre limité de pays ayant des réserves connues de ces éléments. Par exemple, entre 1995 et 2005, la Chine était responsable de plus de 90 % de la production mondiale d’éléments de terres rares ou ETR (les éléments 21, 39 et 57-71 dans le tableau périodique). Ce monopole a encouragé, ailleurs dans le monde, une recherche intensive de sources alternatives pour certains de ces éléments, et les derniers chiffres de production montrent un inventaire des sources un peu plus équilibré (Figure 2).
En deuxième exemple, nous pouvons citer le cas du lithium et du cobalt, dont la demande a augmenté de plus de 6 fois et presque 3 fois, respectivement, entre 2000 et 2018, en grande partie à cause de leur utilisation dans les batteries rechargeables. En 2020, ~ 80 % du lithium provenait de seulement deux pays, l’Australie et le Chili, et > 60 % du cobalt était extrait de la République démocratique du Congo (Reichl and Schatz, 2021).
 Les ETCs posent-ils un danger pour l’environnement?
Les ETCs posent-ils un danger pour l’environnement?
Pour répondre à cette question, il faut tenir compte à la fois des concentrations de ces éléments dans le milieu récepteur, de leur biodisponibilité et de leur toxicité intrinsèque. Il est à noter ici que la répartition entre les formes dissoutes et particulaires dans les eaux naturelles influe beaucoup sur la mobilité des éléments métalliques et sur leur disponibilité envers les organismes vivants; les métaux dissous sont à la fois plus mobiles et plus biodisponibles que les métaux associés aux particules. Déterminer leurs concentrations totales, dissoutes ou particulaires, dans une rivière, un lac ou un estuaire relève de la chimie analytique et ne pose pas trop de problèmes. Cependant, prédire leur biodisponibilité et leur toxicité s’avère nettement plus difficile. La ‘biodisponibilité’ d’un élément métallique représente sa capacité à traverser une membrane biologique et entrer dans un organisme vivant, où il peut provoquer de la toxicité. Pour les métaux comme le cadmium, le cuivre, le plomb, le nickel et le zinc, tous étudiés intensément depuis plus de 50 ans, le meilleur prédicteur de leur biodisponibilité est généralement la concentration de l’ion métallique libre (c’est-à-dire, la concentration de M2+, où M = Cd, Cu, Ni, Pb ou Zn et le ‘2+’ indique la charge portée par l’ion en solution). Pour connaître ces concentrations, nous pouvons soit les mesurer (par exemple, à l’aide de techniques électrochimiques), soit les calculer avec des modèles d’équilibres chimiques. L’application de ces deux approches nous permet de connaître la ‘spéciation’ de ces métaux dans le milieu aquatique. [2] Alors, pourquoi ne pas utiliser la même approche pour les ETCs?/p>
 Pauvreté en données
Pauvreté en données
Le problème ici est double : d’abord, puisque l’intérêt pour ces éléments est tout récent, il manque des techniques analytiques pour déterminer leur spéciation dans les eaux naturelles. Dans de tels cas, on peut normalement contourner le problème en calculant la spéciation des éléments qui nous intéressent à l’aide de modèles. Cependant, l’une des caractéristiques importantes des ETCs est que beaucoup d’entre eux sont pauvres en données thermodynamiques nécessaires pour calculer leur spéciation en solution et leur solubilité dans l’eau. Pour les métaux monovalents et divalents qui dominent la littérature écotoxicologique, la plupart des données nécessaires pour calculer leur spéciation dans des solutions aqueuses sont facilement disponibles dans des bases de données accessibles au public. Cependant, pour de nombreux ETCs, les données thermodynamiques sont incomplètes, en partie parce que la génération de telles données n’est malheureusement plus considérée comme une priorité par des chercheurs ou par les organismes subventionnaires. Cela signifie que pour de nombreux ETCs, nous ne pouvons ni mesurer ni calculer leur spéciation en solution avec confiance.
Pour compliquer le problème, les ETCs sont également pauvres en données écotoxicologiques nécessaires à la prédiction de leurs effets dans le milieu récepteur. De vastes bases de données écotoxicologiques existent pour bon nombre des métaux monovalents et divalents trouvés dans les quatre premières lignes du tableau périodique. Des exemples de telles sources de données incluent la base de données US-ECOTOX (US EPA, 2020) et la base de données européenne ECHA (ECHA, 2020). Elles sont toutes les deux utilisées dans les évaluations de risques toxiques et écotoxiques dans le monde entier. Dans le cas de la plupart des ETCs, cependant, très peu de tests de toxicité ont été réalisés et les données écotoxicologiques sont encore très rares, ce qui limite sévèrement notre capacité à évaluer correctement les éventuels impacts environnementaux de ces ‘nouveaux’ éléments. De plus, des problèmes de solubilité pour certains éléments (c’est notamment le cas pour des éléments des terres rares), couplés avec des tests toxicologiques qui ne tiennent pas compte du phénomène de précipitation (ex. : avec le phosphate ajouté dans les milieux nutritifs normés) peuvent conduire à des résultats trompeurs.
En l’absence de données toxicologiques solides, nous pourrions en principe estimer la toxicité potentielle d’un ETC donné à l’aide de relations quantitatives entre les propriétés ioniques des métaux et leur activité biologique (QICARs).[3] Cette méthodologie a été utilisée avec succès pour prédire la toxicité d’éléments riches en données (Walker et al., 2013), mais peu de tentatives pour prédire la toxicité des ETCs sont encore apparues dans la littérature. L’une des complications potentielles est que les métaux pour lesquels l’approche QICAR s’est avérée efficace sont dominés par des cations monovalents et divalents. Pour ces métaux, comme nous l’avons déjà mentionné, l’ion métallique libre est presque toujours un bon prédicteur de la bioaccumulation et de la toxicité du métal. Cependant, de nombreux ETCs existent dans des états d’oxydation de +III ou plus et nous n’en savons pas encore assez sur leur spéciation ou leurs interactions avec les organismes vivants pour pouvoir conclure que l’ion métallique libre sera un prédicteur fiable de leur toxicité.
En conclusion, des défis évidents demeurent dans le secteur des contaminants inorganiques, liés à la fois à l’augmentation prévue de l’intensité des activités minières et à l’utilisation d’éléments auparavant peu utilisés et peu testés. Cependant, la plupart des défis posés par les ETCs devraient pouvoir être résolus en développant de nouvelles approches ou en adaptant les approches existantes.
Article rédigé par Séverine Le Faucheura, Claude Fortinb et Peter G. C. Campbellb
a Université de Pau et des Pays de l’Adour, E2S UPPA, CNRS, IPREM, Chaire ECOTOX E2S-UPPA-TotalEnergies-Rio Tinto, Pau, France
b Institut national de la recherche scientifique, INRS Eau Terre Environnement, Québec, Québec G1K 9A9, Canada
[1] Par opposition aux contaminants organiques (pesticides, dérivés d’hydrocarbures, organochlorés …), les contaminants inorganiques principalement des métaux restent peu étudiés.
[2] Le mot ‘spéciation’, emprunté de la biologie par les géochimistes, est utilisé pour décrire la répartition d’un élément métallique entre ses diverses ‘espèces’ dissoutes possibles (c’est-à-dire, l’ion métallique libre ainsi que ses complexes inorganiques et organiques). Il s’avère que la toxicité d’un métal dissous dépend de sa spéciation, d’où l’importance de pouvoir calculer ou mesurer la spéciation des éléments métalliques dissous dans l’eau.
[3] Cette approche ressemble à l’utilisation des ‘QSARs’ (Quantitative Structure-Activity Relationships) pour prédire la bioaccumulation et la toxicité de nouveaux contaminants organiques.
Cobelo-García, A., Filella, M., Croot, P., Frazzoli, C., Du Laing, G., Ospina-Alvarez, N., Rauch, S., Salaun, P., Schäfer, J., Zimmermann, S., 2015. COST action TD1407: network on technology-critical elements (NOTICE)—from environmental processes to human health threats. Environmental Science and Pollution Research 22, 15188-15194.
ECHA, 2020. ECHA Information on Chemicals – Registered Substances. European Chemicals Agency, Helsinki, Finland.
Gulley, A.L., Nassar, N.T., Xun, S., 2018. China, the United States, and competition for resources that enable emerging technologies. Proceedings of the National Academy of Sciences 115, 4111-4115.
Reichl, C., Schatz, M., 2021. World Mining Data 2021, International Organizing Committee for the World Mining Congresses. Federal Ministry of Agriculture, Regions and Tourism, Vienna, Austria, p. 268.
US EPA, 2020. ECOTOX User Guide: ECOTOXicology Knowledgebase System. Version 5.3 (available at https://cfpub.epa.gov/ecotox/). U.S. Environmental Protection Agency.
Walker, J.D., Newman, M.C., Enache, M., 2013. Fundamental QSARS for Metal Ions. CRC Press, Taylor & Francis Group, Boca Raton, FL, USA.






