Fongicides SDHI : définition et mode d’action
Les pesticides sont des substances de nature diverse : produits phytosanitaires (utilisés en agriculture), biocides, médicaments à usage vétérinaire. En agriculture conventionnelle, ils sont utilisés pour contrôler, repousser ou détruire des organismes jugés parasites afin d’améliorer les rendements. Les insecticides, herbicides et fongicides rentrent ainsi dans la catégorie des produits phytosanitaires et donc dans celles des pesticides. Compte tenu de la variété des cibles, la nature des pesticides est par essence, elle-même variée.
Les inhibiteurs de la succinate déshydrogénase (succinate dehydrogenase inhibitors, SDHi) sont des fongicides utilisés pour tuer des moisissures qui se développent sur des cultures céréalières, de fruits ou de légumes (1). Ces molécules ont un large spectre (basidiomycètes, adélomycètes et ascomycètes).

Une vingtaine de molécules sont connues mais seulement 12 sont autorisées en France depuis 2020 avec des utilisations variées allant du traitement des semences à celui des sols ou parties aériennes des cultures (céréales (blé, orge), colza, légumes (carottes, salades, poireaux), fruits (fraises, pommes, vigne, et melons).
En termes de volume de ventes, en France, les chiffres se situent entre 500 et 700 tonnes de substance active par an avec des molécules représentatives comme le boscalide qui fut l’un des premiers utilisés.
De nouvelles générations de SDHi ont été développées avec le temps, remplaçant progressivement le boscalide comme le bixafène ou le fluopyram. De ce fait, on recense environ 150 spécialités commerciales autorisées en France, pour certaines utilisées aussi pour le traitement des terrains de golf.
Les SDHi sont parfois retrouvés dans des échantillons aériens (après pulvérisation) ; toutefois, l’élément le plus inquiétant est leur potentielle bioaccumulation dans les sols car la plupart de ces molécules sont caractérisées comme persistantes selon la règlementation européenne (2). Dans les eaux, hormis le boscalide, la présence de ces fongicides n’est pas recherchée et n’est donc pas connue (3).
A terme, le réchauffement climatique pourrait conduire dans les prochaines années à une augmentation des contaminations par les moisissures (4,5) et donc à une intensification de l’usage des fongicides. Ceux-ci ont des modes d’action variés ; les SDHi ont pour particularité de cibler une enzyme intracellulaire mitochondriale impliquée dans la respiration : la succinate déshydrogénase (ou SDH). D’autres fongicides sont connus pour inhiber ce processus. La SDH a toutefois une particularité : être impliquée dans deux processus métaboliques mitochondriaux, le cycle de Krebs et la chaîne respiratoire.
La SDH, une cible mitochondriale, conservée dans l’évolution :
Revenons un instant sur les processus mitochondriaux pour bien comprendre les enjeux de l’usage des SDHi et leur conséquence potentielle en termes de santé publique.
Les cellules animales possèdent pour la plupart des petites structures internes appelées mitochondries qui sont le siège de la production d’ATP (adénosine triphosphate),source principale d’énergie de la cellule. Les mitochondries sont donc des usines produisant de l’énergie mais cette fonction ne peut se faire sans une molécule particulière : le dioxygène ou O2. Deux schémas métaboliques sont couplés pour permettre cette production d’ATP dépendante de l’O2 : le cycle de Krebs et la chaine respiratoire (appelée ainsi car c’est elle qui utilise le dioxygène en bout de chaîne). La SDH est un constituant essentiel de ces deux schémas métaboliques. L’inhiber revient à priver les cellules de leur source principale d’énergie. En résumé, les SDHi tuent les cellules en les privant de la possibilité de fabriquer suffisamment d’énergie (Figure 1).
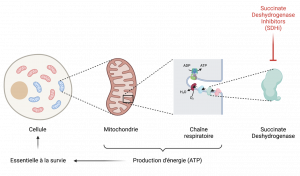
Figure 1 : mode d’action des SDHi. Ceux-ci inhibent une enzyme intracellulaire et intra-mitochondriale participant à la chaîne respiratoire permettant la production d’ATP (associée à une consommation de O2), carburant énergétique essentiel pour la cellule.
Ces fongicides ont été développés dans le but d’inhiber précisément la SDH des moisissures. C’est le terme ‘précisément’ qui pose ici un problème : des études récentes montrent que les SDHi pourraient inhiber de nombreuses autres SDH, entendons par là, d’autres espèces (considérées donc comme non-cibles) (6). La palette est immense allant d’autres microorganismes (bénéfiques pour certains) jusqu’aux mammifères dont l’être humain. Ceci n’est pas en soi une réelle surprise. En effet, la séquence et la structure des SDH est bien connue dans le règne animal et a peu évolué, compte tenu de son importance cellulaire. Les SDHi pourraient donc être de redoutables poisons pour les moisissures indésirables mais aussi pour de nombreuses autres espèces du fait de leur non-spécificité, une problématique rémanente dans le domaine du développement industriel des pesticides (d’où leur impact plus que suspecté en termes de biodiversité). Par exemple, le boscalide modifie le microbiote des abeilles et leur comportement. De plus, malgré la conservation de la structure de la SDH, l’effet des SDHi pourrait être plus important chez certains organismes non-cibles comme le porc ou certains poissons du fait d’une affinité plus importante.
La perte de fonction de la SDH : un problème de santé publique ?

Au-delà de cette problématique écosystémique, le mode d’action des SDHi pose de nombreuses questions inhérentes à la perte de fonction de la SDH chez l’être humain. Cette enzyme est composée de plusieurs sous-unités (A, B, C, D).Dans les années 90, des déficits génétiques de plusieurs sous-unités de la SDH ont été identifiés en lien avec des pathologies graves de nature diverse : atteintes neurologiques de l’enfant, cardiopathies (7), leucodystrophies (8), encéphalopathies (9), cancers (hypophyse, rein, intestin, phéochromocytome) (10–16).
Comment expliquer l’apparition de ces pathologies en lien avec une inactivation génétique de la SDH ? L’enzyme convertit le succinate en fumarate au niveau mitochondrial.
Son inactivation conduit donc à une accumulation de succinate dans la mitochondrie puis dans le cytoplasme des cellules. Ce métabolite conduit à une stimulation ‘artificielle’ des voies de signalisation activées lors d’une hypoxie (baisse de la pression partielle en O2) notamment de la voie HIF-1α (Hypoxia Inducible Factor-1 alpha). Ces voies sont importantes au cours du développement embryonnaire, ou en cas d’adaptation physiologique lors d’une hypoxie (vie en haute montagne, apnée). Elles sont toutefois aussi activées lors de la formation d’une masse tumorale, le centre de la tumeur étant hypoxique ; dans ce contexte, elles permettent d’activer la formation de nouveaux vaisseaux sanguins facilitant la survie des cellules tumorales et à plus long terme leur dissémination. Le succinate altère également certaines régulations épigénétiques cellulaires facilitant l’acquisition d’un phénotype plus disséminant par les tumeurs (transition épithélio-mésenchymateuse).
Au-delà de cet effet lié à ce métabolite, désormais appelé oncométabolite du fait de ses propriétés pro-oncogéniques, l’inactivation de la SDH au niveau de la chaîne respiratoire entraine un « embouteillage » d’électrons, propre à conduire à une utilisation non conforme du O2, et ainsi à la production de dérivés réactifs du dioxygène (DRO), qui peuvent endommager certaines structures cellulaires comme l’ADN, contribuant à l’apparition de tumeurs.
Un parallèle inquiétant ?
Ces données sur l’inactivation génétique de la SDH soulèvent des questions en matière de santé publique. Une inhibition même partielle de la SDH par des inhibiteurs comme les SDHi serait-elle en mesure de reproduire certains événements de santé décrits précédemment ? La question se pose à la fois pour les applicateurs de fongicides mais aussi pour les consommateurs de denrées potentiellement contaminées surtout en cas de sensibilité accrue liée à d’autres déficits de la chaine respiratoire (6).
Il n’existe effectivement pas de données de biosurveillance chez l’être humain (17) et pour ce qui est du suivi des SDHi dans les aliments, de nombreux programmes de surveillance se sont focalisés sur le boscalide dont l’utilisation a tendance à être remplacée par d’autres SDHi. En termes de biodistribution dans les organismes, celle-ci est principalement connue chez le rat à la suite d’une exposition par voie orale.
L’élimination se fait essentiellement par les voies urinaires et biliaires mais avec des durées de présence dans l’organisme variables (entre 1 jour et 1 semaine). Réalisées sur un modèle en laboratoire, il serait donc intéressant d’obtenir plus de données chez l’être humain, qui peut être exposé de manière répétée via certains aliments. Il n’existe en effet qu’une seule étude réalisée en France (cohorte Elfe, population générale) visant à détecter un SDHi, le boscalide : celui-ci est détecté dans près de 2/3 des cheveux analysés.
Une réglementation à faire évoluer ?
Si on prend l’exemple du cancer, comment est évaluée la possible cancérogénicité des pesticides ou d’autres produits mis sur le marché ? Les principaux mécanismes étudiés par le biais de tests réglementaires réalisés par les producteurs de pesticides eux-mêmes sont des tests de génotoxicité, mutagénicité et cancérogénicité. Une substance est dite génotoxique lorsqu’elle est susceptible d’entraîner un dysfonctionnement ou une altération du génome en endommageant l’ADN ; la mutagénicité et la cancérogénicité sont respectivement la propension d’une substance à provoquer des mutations génétiques ou des cancers. Les tests utilisés sont nombreux et se basent sur des modèles in vitro et in vivo.
Ces trois types de tests se focalisent en fait sur les 2 premières étapes de la cancérogenèse : l’initiation (apparition et survie d’un clone tumoral porteur de plusieurs mutations génétiques) et la promotion (prolifération du clone pour former une masse tumorale). Si la plupart des tests concluent à une absence de génotoxicité pour les SDHi, les tests de cancérogénicité suggèrent que ceux-ci favorisent l’apparition de diverses formes de cancers dans différents organes (foie, thyroïde, poumon et utérus), avec des effets différents entre femme et homme.
Pour expliquer ce phénomène (chez le rongeur), les autorités se sont basées sur l’activation d’un récepteur particulier qui est liée à des processus cancérogènes mais spécifiquement chez le rongeur. La proposition de retenir ce récepteur comme principale voie susceptible de conduire à un cancer (spécifique aux rongeurs mais pas à l’être humain) (18) n’a pas entrainé le retrait de ces produits (du fait de la non-pertinence pour l’être humain). De plus, les mécanismes décrits préalablement (accumulation du succinate, pseudo-hypoxie, transition épithélio-mésenchymateuse) sont liés à la troisième étape de la cancérogenèse c’est à dire la progression tumorale ou apparition de métastases cancéreuses. Les SDHi sont par ailleurs suspectés d’être des perturbateurs endocriniens chez plusieurs espèces (19–22).
 L’OCDE mène actuellement une réflexion sur le fait de faire évoluer la réglementation notamment pour évaluer le potentiel cancérogène de substances non génotoxiques (23) telles que les SDHi, en incluant des tests in silico (AOP ou Adverse Outcome Pathway) ou de nouveaux essais expérimentaux (mesurant le stress oxydant (une trop grande production de radicaux libres, dérivés de l’O2), ou les modifications épigénétiques (modification de la structure de l’ADN sans modification de séquence, qui affecte néanmoins l’expression des gènes). Dans ce cadre, il apparaît également essentiel d’envisager de tester les formulations et pas seulement les molécules actives : les formulations de pesticides sont en effet la combinaison d’un ou plusieurs ingrédients actifs (le ou les pesticides), et de plusieurs ingrédients inertes (ex : solvants). Les formulations correspondent à des mélanges qui sont représentatifs d’un point de vue environnemental car ce sont elles qui sont utilisées en pratique (agriculture, emploi vétérinaire). Un mélange de molécules peut avoir un effet différent que la simple somme des effets des molécules seules d’où l’importance de tester les formulations, plutôt que les SDHi seuls.
L’OCDE mène actuellement une réflexion sur le fait de faire évoluer la réglementation notamment pour évaluer le potentiel cancérogène de substances non génotoxiques (23) telles que les SDHi, en incluant des tests in silico (AOP ou Adverse Outcome Pathway) ou de nouveaux essais expérimentaux (mesurant le stress oxydant (une trop grande production de radicaux libres, dérivés de l’O2), ou les modifications épigénétiques (modification de la structure de l’ADN sans modification de séquence, qui affecte néanmoins l’expression des gènes). Dans ce cadre, il apparaît également essentiel d’envisager de tester les formulations et pas seulement les molécules actives : les formulations de pesticides sont en effet la combinaison d’un ou plusieurs ingrédients actifs (le ou les pesticides), et de plusieurs ingrédients inertes (ex : solvants). Les formulations correspondent à des mélanges qui sont représentatifs d’un point de vue environnemental car ce sont elles qui sont utilisées en pratique (agriculture, emploi vétérinaire). Un mélange de molécules peut avoir un effet différent que la simple somme des effets des molécules seules d’où l’importance de tester les formulations, plutôt que les SDHi seuls.
Conclusions
Les SDHi soulèvent, du fait de leur mode d’action et de par leur utilisation croissante, de nombreuses questions au sein de la communauté scientifique et des instances de gestion et de régulation. Impactant des espèces non-cibles au sein des écosystèmes, leurs effets sur la santé humaine sont aussi largement débattus du fait des conséquences d’une inactivation génétique de leur cible principale, la SDH. Ce débat a le mérite de soulever la question d’une évolution des tests réglementaires et également de la nécessité de mener des études épidémiologiques encore trop insuffisantes ainsi que d’approfondir les études écotoxicologiques.
Rédaction : Pr. Xavier Coumoul, membre du conseil scientifique de la Fondation, Directeur de l’équipe INSERM – METATOX, Vice-président à la Culture scientifique et à son Rayonnement de l’Université de Paris, et Sylvie Bortoli, ingénieure de recherche et à l’Université Paris Descartes et membre de l’Inserm
Relecture : Fondation evertéa.
1. Pesticides et effets sur la santé – Synthèse [Internet]. INSERM. 2021. Disponible sur: https://www.inserm.fr/wp-content/uploads/2021-06/inserm-expertisecollective-pesticides2021-synthese.pdf
2. Organisation des Nations Unies pour l’alimentation et l’agriculture, Organisation mondiale de la santé, éditeurs. Pesticide residues in food 2008: joint FAO/WHO meeting on pesticide residues. Rome: WHO FAO; 2009. (FAO plant production and protection papers).
3. Commissariat général au développement durable. Les pesticides dans les cours d’eau français en 2013 : Commissariat général au développement durable, 2015. In. Disponible sur: https://www.statistiques.developpement-durable.gouv.fr/sites/default/files/2018-10/chiffres-stats697-pesticides-dans-cours-deau2013-novembre2015.pdf
4. Lee HJ, Ryu D. Worldwide Occurrence of Mycotoxins in Cereals and Cereal-Derived Food Products: Public Health Perspectives of Their Co-occurrence. J Agric Food Chem. 23 août 2017;65(33):7034‑51.
5. Battilani P, Toscano P, Van der Fels-Klerx HJ, Moretti A, Camardo Leggieri M, Brera C, et al. Aflatoxin B1 contamination in maize in Europe increases due to climate change. Sci Rep. 12 avr 2016;6:24328.
6. Bénit P, Kahn A, Chretien D, Bortoli S, Huc L, Schiff M, et al. Evolutionarily conserved susceptibility of the mitochondrial respiratory chain to SDHI pesticides and its consequence on the impact of SDHIs on human cultured cells. PLoS One. 2019;14(11):e0224132.
7. Courage C, Jackson CB, Hahn D, Euro L, Nuoffer J-M, Gallati S, et al. SDHA mutation with dominant transmission results in complex II deficiency with ocular, cardiac, and neurologic involvement. Am J Med Genet. janv 2017;173(1):225‑30.
8. Alston CL, Davison JE, Meloni F, van der Westhuizen FH, He L, Hornig-Do H-T, et al. Recessive germline SDHA and SDHB mutations causing leukodystrophy and isolated mitochondrial complex II deficiency. J Med Genet. sept 2012;49(9):569‑77.
9. Ma Y-Y, Wu T-F, Liu Y-P, Wang Q, Li X-Y, Ding Y, et al. Two compound frame-shift mutations in succinate dehydrogenase gene of a Chinese boy with encephalopathy. Brain and Development. mai 2014;36(5):394‑8.
10. Dwight T, Mann K, Benn DE, Robinson BG, McKelvie P, Gill AJ, et al. Familial SDHA mutation associated with pituitary adenoma and pheochromocytoma/paraganglioma. J Clin Endocrinol Metab. juin 2013;98(6):E1103-1108.
11. Killian JK, Kim SY, Miettinen M, Smith C, Merino M, Tsokos M, et al. Succinate Dehydrogenase Mutation Underlies Global Epigenomic Divergence in Gastrointestinal Stromal Tumor. Cancer Discovery. juin 2013;3(6):648‑57.
12. Letouzé E, Martinelli C, Loriot C, Burnichon N, Abermil N, Ottolenghi C, et al. SDH mutations establish a hypermethylator phenotype in paraganglioma. Cancer Cell. 10 juin 2013;23(6):739‑52.
13. Ni Y, Seballos S, Ganapathi S, Gurin D, Fletcher B, Ngeow J, et al. Germline and somatic SDHx alterations in apparently sporadic differentiated thyroid cancer. Endocr Relat Cancer. avr 2015;22(2):121‑30.
14. Bausch B, Schiavi F, Ni Y, Welander J, Patocs A, Ngeow J, et al. Clinical Characterization of the Pheochromocytoma and Paraganglioma Susceptibility Genes SDHA, TMEM127, MAX, and SDHAF2 for Gene-Informed Prevention. JAMA Oncol. 1 sept 2017;3(9):1204‑12.
15. Calió A, Grignon DJ, Stohr BA, Williamson SR, Eble JN, Cheng L. Renal cell carcinoma with TFE3 translocation and succinate dehydrogenase B mutation. Mod Pathol. mars 2017;30(3):407‑15.
16. Lepoutre-Lussey C, Thibault C, Buffet A, Morin A, Badoual C, Bénit P, et al. From Nf1 to Sdhb knockout: Successes and failures in the quest for animal models of pheochromocytoma. Mol Cell Endocrinol. 5 févr 2016;421:40‑8.
17. Anses. Évaluation du signal concernant la toxicité des fongicides inhibiteurs de la succinate deshydrogénase (SDHI). Rapport d’expertise collective. « GECU SDHI ». In: Anses. Paris; 2019. p. 1‑103. Disponible sur: https://www.anses.fr/fr/system/files/PHYTO2018SA0113Ra.pdf
18. Elcombe CR, Peffer RC, Wolf DC, Bailey J, Bars R, Bell D, et al. Mode of action and human relevance analysis for nuclear receptor-mediated liver toxicity: A case study with phenobarbital as a model constitutive androstane receptor (CAR) activator. Crit Rev Toxicol. janv 2014;44(1):64‑82.
19. Yang Y, Liu W, Mu X, Qi S, Fu B, Wang C. Biological response of zebrafish embryos after short-term exposure to thifluzamide. Sci Rep. 7 déc 2016;6:38485.
20. Yang Y, Qi S, Wang D, Wang K, Zhu L, Chai T, et al. Toxic effects of thifluzamide on zebrafish (Danio rerio). J Hazard Mater. 15 avr 2016;307:127‑36.
21. Teng M, Zhou Y, Song M, Dong K, Chen X, Wang C, et al. Chronic Toxic Effects of Flutolanil on the Liver of Zebrafish ( Danio rerio). Chem Res Toxicol. 17 juin 2019;32(6):995‑1001.
22. Qian L, Zhang J, Chen X, Qi S, Wu P, Wang C, et al. Toxic effects of boscalid in adult zebrafish (Danio rerio) on carbohydrate and lipid metabolism. Environ Pollut. avr 2019;247:775‑82.
23. Jacobs MN, Colacci A, Corvi R, Vaccari M, Aguila MC, Corvaro M, et al. Chemical carcinogen safety testing: OECD expert group international consensus on the development of an integrated approach for the testing and assessment of chemical non-genotoxic carcinogens. Arch Toxicol. août 2020;94(8):2899‑923.







Pretty great post. I just stumbled upon your log and wished to say that I have
truly loved browsing your weblog posts. In any
case I’ll be subscribing for your rss feed and I hope you write once more very soon!
Look at my blog – https://elegants-shop.com/ar/2024/06/08/professional-in-the-area-for-water-english-the-right/